shotshop.com
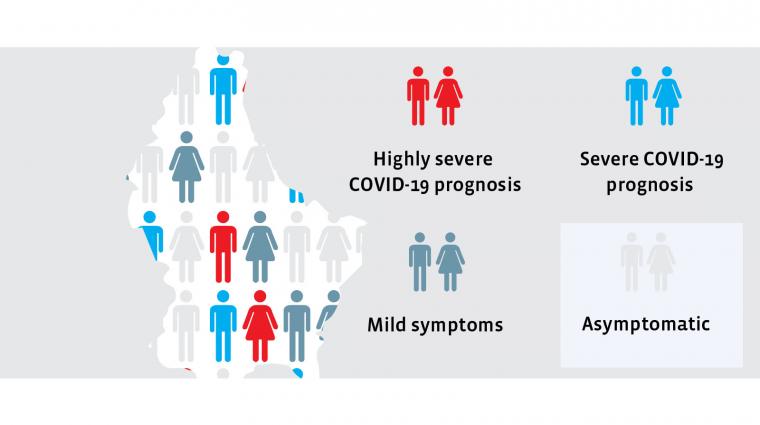
Einige Covid-19 Patienten landen im Krankenhaus (links), während andere nur milde Erkältungssymptome verspüren (rechts)
Die Krankheitsverläufe von Menschen, die positiv auf Sars-CoV-2 getestet werden, sind sehr unterschiedlich. Einige Menschen bemerken überhaupt keine Symptome, für viele andere verläuft der Krankheitsverlauf mild, für wieder andere durchaus heftiger, aber ohne ins Krankenhaus zu müssen. Und dann gibt es Patienten, die im Krankenhaus oder sogar in der Intensivstation behandelt werden müssen. Es ist dieser Andrang auf die Intensivstationen, der die Gesundheitssysteme in die Knie zwingt.
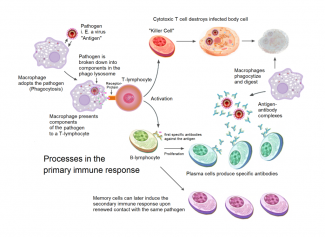
Was passiert bei einer Infektion mit Sars-CoV-2 im Körper? Was genau ist die Krankheit Covid-19?
Patienten mit schlimmeren Verläufen kämpfen nicht nur mit dem Virus, sondern auch mit sich selbst. Mit ihrem eigenen Immunsystem. Denn dieses ins Chaos zu stürzen, das ist die eigentliche Krankheit, die das neue Coronavirus Sars-CoV-2 auslöst. Zwar haben die Intensivpatienten jede Menge Antikörper gegen das Virus im Blut, doch diese schaffen es nicht, die Infektion unter Kontrolle zu bringen. Einige dieser Patienten werden sterben, andere werden noch Monate, wenn nicht Jahre an den Folgen der Krankheit leiden. Woher kommt das?
In diesem Artikel versuchen wir etwas detailliertere Antworten auf einige Fragen rund um die Immunantwort auf Sars-Cov-2 und die unterschiedlichen Krankheitsverläufe von Covid-19 zu geben. Um den Artikel übersichtlicher zu gestalten, haben wir die einzelnen Fragen alle als aufklappbare Kästchen strukturiert. Sag uns gerne in der Umfrage am Ende des Artikels, ob Dir diese Darstellung gefällt oder nicht.
Autor: Cornelia Eisenach (Scitec Media)
Editoren: Jean-Paul Bertemes (FNR), Michèle Weber (FNR)
Illustration : me=Sciencia58 an the makers of the single images Domdomegg, [1], Fæ, Petr94, Manu5 via Wikimedia Commons, CC-BY-SA-4.0